
Si nos atenemos a lo que nos explicaban en las clases de química, el helio es el segundo gas menos reactivo que existe. En condiciones normales es inerte y monoatómico y sus átomos no se asocian con otros elemento para formar compuestos. Parece que las clases de química necesitan actualizarse.
Los átomos están formados por un núcleo de protones con carga positiva rodeados por electrones con carga negativa. Cuantos más protones tenga en el núcleo, más electrones puede sostener. Esos electrones se organizan en capas concéntricas.
Los átomos de un elemento se unen a los de otro compartiendo electrones en sus capas más externas, pero si esos niveles está llenos, normalmente no se unen. Los átomos de gases nobles como el helio o el neón tienen las capas exteriores completas, por lo que los átomos no se pueden unir a otros de manera tradicional.

Algunos gases nobles han demostrado ser capaces de combinarse si los sometemos a altísimas presiones, pero el helio había permanecido inalterable hasta ahora. Como mucho, se habían logrado unir átomos de helio enfriándolos hasta el punto de que se unen gracias a las fuerzas de van der Waals, pero son compuestos inestables.
Lo que se ha logrado ahora es, si se confirma, crear el primer compuesto estable de helio. Suena simple, pero es algo que desafía completamente la química tal y como la conocemos. El doctor Ivan Popov, uno de los principales autores del estudio explica que “la química cambia cuando se la somete a altas presiones como las que hay en el núcleo de nuestro planeta o en los gigantes gaseosos, pero esto es revolucionario.” Los resultados del experimento de Popov y su equipo aún están pendientes de revisión.
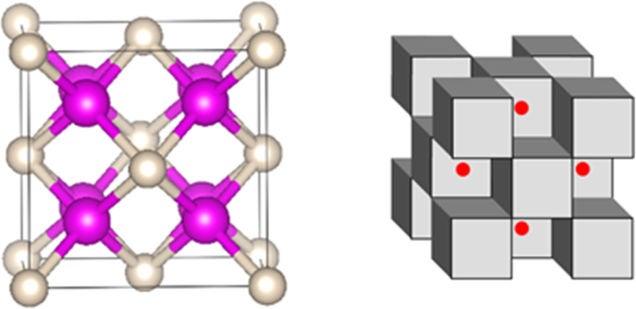
El compuesto se ha logrado sometiendo helio en estado gaseoso y cristales de sodio a altísimas presiones mediante un yunque de diamante. El resultado es una estructura cristalina cúbica en la que los átomos de helio comparten los electrones con los de sodio. No es una unión en el sentido estricto de la palabra, pero es estable y responde a la fórmula Na
2
He.
Henry Rzepa, profesor de química del Colegio Imperial de Londres, cree que, aunque otros grupos aún tienen que poder replicar el experimento para validarlo sus resultados sí que podrían estar en lo cierto. “Hace tiempo que sospechábamos que existe una química diferente y regida por normas muy diferentes bajo condiciones extremas de alta presión. Este compuesto de helio y sodio es un fascinante atisbo de esta nueva frontera.”
El descubrimiento es de mucha utilidad para el estudio de la química que tiene lugar en el interior de planetas gaseosos como Júpiter. [vía Nature Chemistry ]



